Einsatz des MS-Arzneimittels Alemtuzumab wird eingeschränkt
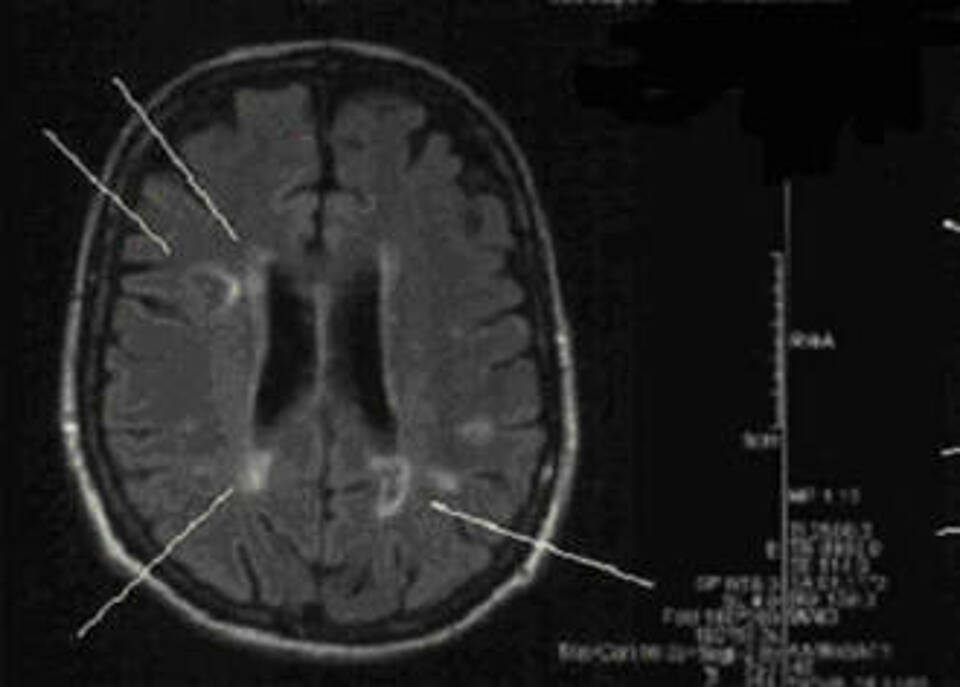
Bei MS kommt es zu Schädigungen an den Nervenzellen; je nach Lage der Läsionen sind vielfältige neurologische Symptome möglich
Bereits im vergangenen Jahr hatte die US-Arzneimittelbehörde FDA davor gewarnt, dass es bei der Anwendung des MS-Mittels Alemtuzumab zu ischämischen und hämorrhagischen Schlaganfällen und Gefäßrissen in den Arterien kommen kann. Auch einige Todesfälle wurden registriert.
Im April diesen Jahres machte dann die europäische Arzneimittel-Agentur EMA auf ein weiteres Risiko aufmerksam. Alemtuzumab, ein Anti-CD52-Antikörper, der als Wirkstoff im Medikament Lemtrada enthalten ist, kann demnach schwere immunvermittelte Reaktionen auslösen. So ist es seit der Zulassung im Jahr 2013 zu mehreren Hepatitis-Erkrankungen und zu Fällen einer hämophagozytischen Lymphohistiozytose gekommen – Folgen einer unkontrollierten Aktivierung von Lymphozyten und Makrophagen. Auch hier war der Ausgang der Erkrankungen teilweise tödlich.
Alemtuzumab nur noch bei hochaktiver MS
Als Reaktion empfiehlt der Ausschuss für Risikobewertung im Bereich Pharmakovigilanz (PRAC) nun, Alemtuzumab nur noch bei MS-Patienten einzusetzen,
- deren MS hochaktiv verläuft und die auf mindestens eine krankheitsmodifizierende Therapie nicht angesprochen haben oder
- bei denen die Erkrankung rasch voranschreitet (d.h. die mindestens zwei Schübe mit Behinderungsprogression innerhalb eines Jahres und mit einem oder mehr Gadolinium-anreichernden Läsionen oder mit einer signifikanten Erhöhung der T2-Läsionen im Vergleich zu einem kürzlich durchgeführten MRT aufweisen)
Weiterhin dürfen MS-Patienten, die zusätzlich unter bestimmten Erkrankungen des Herzens, Kreislauf- oder Blutungsstörungen leiden oder weitere Autoimmunerkrankungen haben, künftig kein Alemtuzumab mehr erhalten.
PRAC empfiehlt Behandlung ausschließlich in Krankenhäusern
Ursprünglich wurde Alemtuzumab bei Leukämie eingesetzt, bis Mediziner herausfanden, dass es hochwirksam bei schubförmiger MS ist. Zugelassen ist Alemtuzumab laut Fachinformation „zur Behandlung von erwachsenen Patienten mit schubförmig-remittierender Multipler Sklerose (RRMS, relapse remitting multiple sclerosis) mit aktiver Erkrankung, definiert durch klinischen Befund oder Bildgebung.“ Im April 2019 hatte der PRAC bereits temporäre risikominimierende Maßnahmen zu Alemtuzumab angeordnet. Diese werden nun durch die finale Entscheidung abgelöst.
Neben den genannten Einschränkungen empiehlt die PRAC auch, Behandlung mit Lemtrada ausschließlich in Krankenhäusern durchzuführen, wo Experten arbeiten, die Erfahrung mit Alemtuzumab haben, und wo die Möglichkeit intensivmedizinischer Therapien besteht. So können mögliche schwerwiegende Nebenwirkungen schnell behandelt werden. Zudem soll der Leitfaden für Ärzte und Patienten ergänzt werden.
Foto: DGN